

本期推荐 & 解读 BY
张旌扬 | 美国伊利诺伊大学厄巴纳-香槟分校
▼
咔唑类生物碱因其具有广泛的生物活性而在很长一段时间内成为研究焦点。这一类天然产物可以从陆生植物、微生物、黏菌和藻类等分离得到。在2019年,Yan-Hui Fu课题组从黄皮(Clausena lansium)中分离出了包含clausenalansine A在内的一系列全新的咔唑类生物碱。

Valerie Lösle, Olga Kataeva, Hans-Joachim Knölker
Synthesis 2021; 53(02): 359-364 / DOI: 10.1055/s-0040-1706551
Clausenalansine A是一类吡喃并[3,2-a]咔唑类生物碱,是同类生物碱koenine (2) 的氧化衍生物。2016年,Hans-Joachim Knölker课题组报导了吡喃并[3,2-a]咔唑类生物碱clauraila E (3) 和murrayamine-A (4) 的全合成,基于这一研究基础,该课题组着手研究并完成了clausenalansine A的首次全合成。
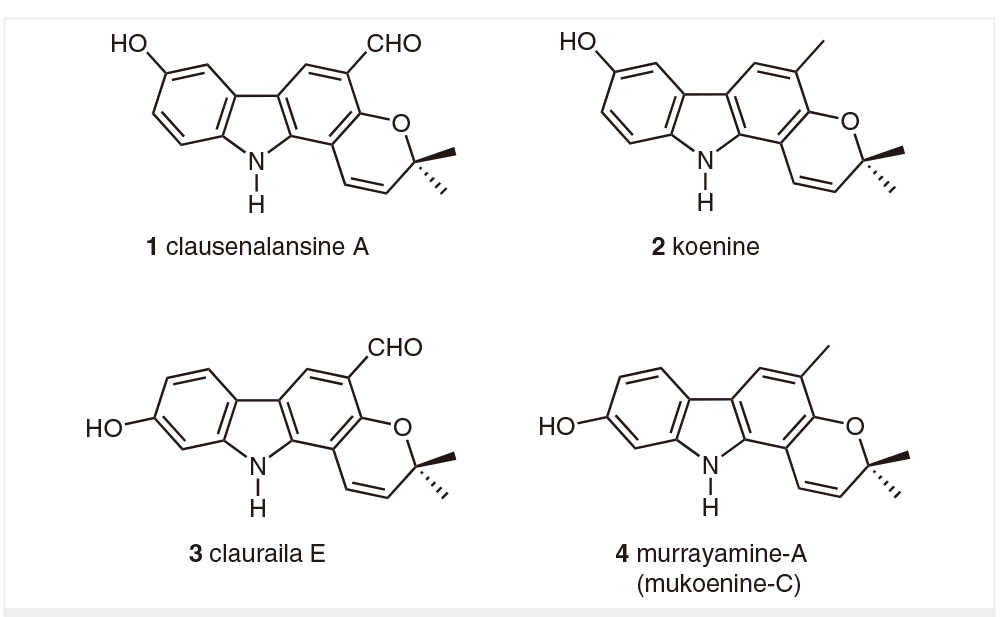
图1 | 吡喃并[3,2-a]咔唑类生物碱
基于clausenalansine A的结构特点,Knölker课题组设计了如下的合成路线(图 2)。整条路线采用合成-后修饰策略,先经由Buchwald-Hartwig胺化反应和钯催化的氧化环化构建前体分子5,之后再氧化甲基得到目标分子clausenalansine A。
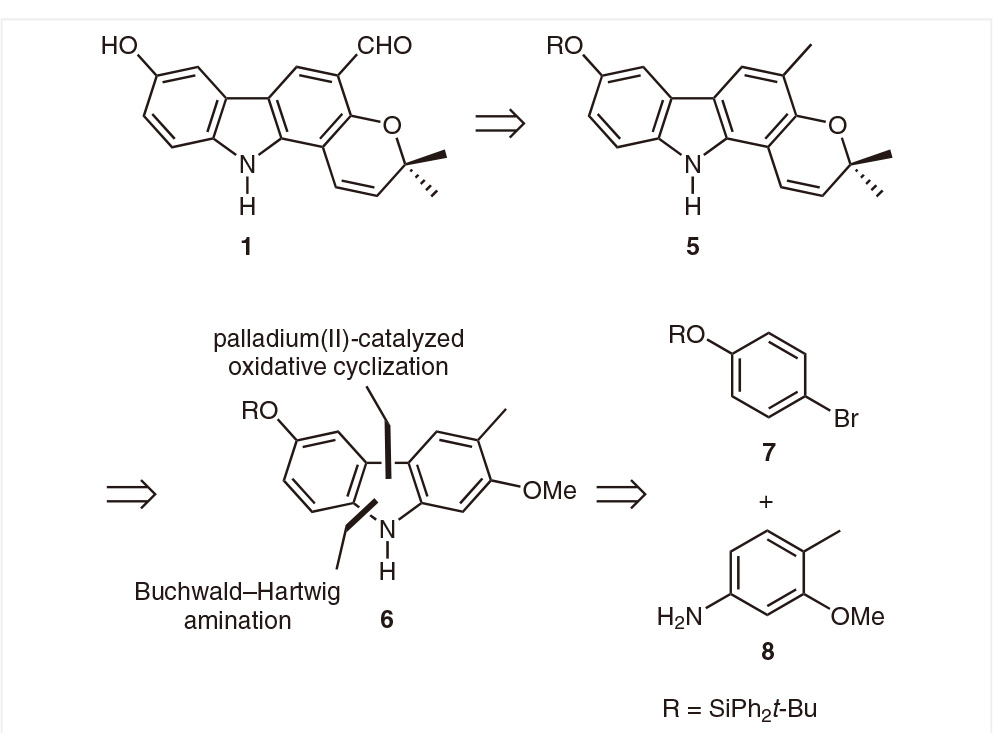
图2 | Clausenalansine A 的逆合成分析
在具体的合成路线上(图 3),作者以二苯基叔丁基硅基保护的对溴苯酚7和4-甲基-3-甲氧基苯胺8为原料,经过一个Buchwald-Hartwig胺化反应得到9,之后再通过钯催化的氧化偶联反应,在微波条件下反应一小时得到化合物6。这一化合物随后在三溴化硼的作用下脱去甲基保护,与2-甲基-2-丁烯醛反应从而实现增环,完成clausenalansine A骨架的构建。
在完成了目标分子的骨架后,作者开始进行最后的氧化及保护基脱除等修饰。在通过条件筛选后,作者确定了DDQ氧化的最佳反应温度及时间(表1),将分子5转化为分子11。随后加入四丁基氟化铵脱去硅基保护,完成了clausenalansine A分子全合成。在完成了clausenalansine A的全合成后,作者对其进行了表征并通过X射线衍射确定了其晶体结构。

表1 | 氧化条件筛选
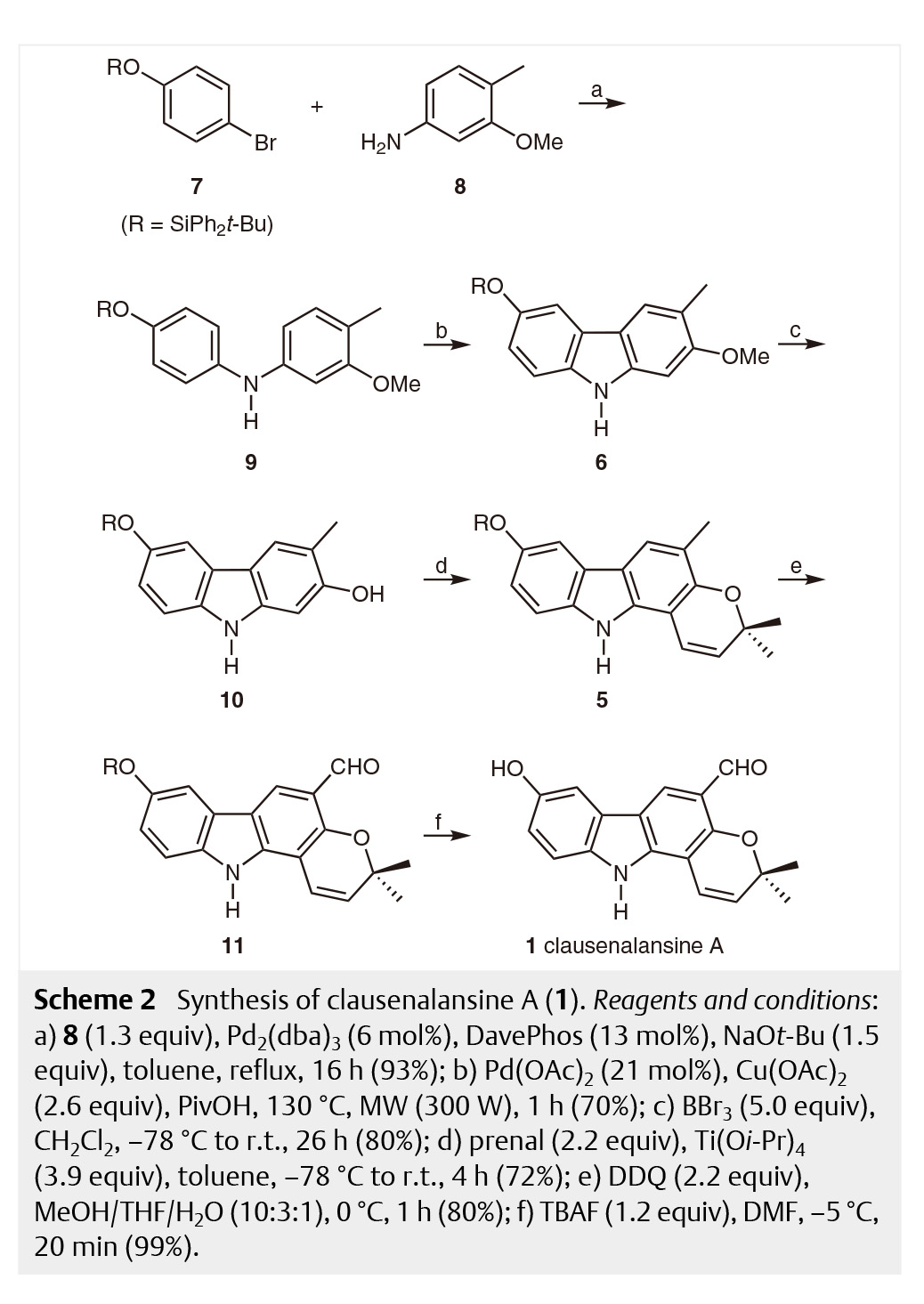
图3 | Clausenalansine A 的全合成
总结与评述 //
Hans-Joachim Knölker课题组完成了吡喃并[3,2-a]咔唑类生物碱clausenalansine A的首次全合成,并对其晶体结构进行了表征。整个合成工作一共7步,从商业可得的原料出发,总收率30%。其简洁的合成步骤和简单的转化为后续可能的衍生化及药物化学研究提供了可能。例如,可以通过在前期使用含有卤原子的原料在后期通过偶联反应等相关转化方便地引入其他基团或与其他分子相连接,或是采用具有不同结构的类似物作为原料,为分子引入不同的结构及生物活性。整个工作让我们看到了天然产物全合成的“初心”:鉴定天然产物结构,也让我们感受到了天然产物全合成为药物化学发展带来的启发和灵感。
