
Minimized Hemodiafiltration for Extracorporeal Membrane Oxygenation in Infants
最小化血液透析滤过在婴儿体外膜肺氧合中的应用
Kwapil et al.
关键词:血液透析滤过、婴幼儿、肌酐清除率、ECMO、血液滤过、尿素、硫酸盐
**中文内容仅供参考,一切以英文原文为准。
背景:液体超负荷是婴幼儿体外膜肺氧合(ECMO)治疗中的严重并发症。如果不及时治疗,容量超负荷会导致ECMO治疗时间延长。儿科患者选择的肾脏替代治疗是使用一台通过Shaldon导管或直接连接到ECMO系统的“大型”血液滤过机,进行腹膜透析或常规血液透析。本研究描述了一种新型最小化血液透析滤过(HDF)系统在ECMO儿科患者中的应用。
方法:这项回顾性分析包括13名体重不超过5 kg的婴幼儿,他们接受了15次使用HDF静脉-动脉(V-A)ECMO治疗。将最小化HDF系统集成到现有ECMO系统(18 mL预充体积)中,在ECMO泵之前,氧合器后,连接到静脉通路。两个输注泵连接到血液滤过器的入口和出口,用于控制HDF系统。
除了6个规定时间点的保留值(肌酸和尿素)外,还检查了流速、透析参数和容量抽取以及HDF系统更换次数。
结果:ECMO的平均运行时间为156小时,HDF系统使用131小时。通过血液滤过器的平均血流量为192 mL/min。透析液平均流量为170 mL/h,平均容量剥夺为39 mL/h。7例患者更换HDF系统1次,3例患者更换2次。
结论:在所有15次应用中,最小化HDF系统均未出现并发症。当使用ECMO治疗婴儿时,它能进行安全的患者容量管理,并有效消除尿液中物质。
简介
体外膜肺氧合(ECMO)是需要机械循环支持的先天性心脏病儿科患者的一种治疗选择,尤其是在低心输出量综合征的情况下。胸外科医师协会报告称,心脏手术围手术期ECMO的使用率为2.8%。与潜在的心脏问题相结合,在治疗之前或治疗期间可能发生排尿减少直至急性肾衰竭。经典疗法是使用Shaldon导管的血液透析或腹膜透析。这两种手术都可能导致应用相关的并发症或副作用,例如内脏器官和/或心脏上的腹膜压力增加。标准连续性肾脏替代治疗(CRRT)器械受限于通路问题、因巨大的无涂层表面或血液-空气接触导致的凝血而导致的系统故障。在ECMO中使用CRRT器械可能导致非预期的过度滤过或其他并发症。
用于成人患者血液透析滤过(HDF)的CRRT器械由于内压的概念化更高,提供了将CRRT器械与ECMO系统集成的简化可能性。在儿科领域,这是不可行的,因为CRRT器械与患者血容量之间的体积比更差。面对这些问题,在治疗团队的内部临床咨询后,在ECMO系统上概念化并实施了一种新型的用于容量剥夺的最小化儿科HDF系统。
患者与方法
在2019年7月至2022年4月的一项回顾性分析中,13名体重不超过5.1kg的婴儿在发生低流量综合征的情况下入选,这些婴儿接受了15次静脉动脉(V-A)ECMO治疗(使用HDF)。
最小化HDF系统的使用可作为肾脏替代疗法集成到当前ECMO回路(配备1/4” DP3泵头和Hilite LT800氧合器的迷你肺小型套件,Fresenius, BadHomburg, Germany)中。为了在现有ECMO系统中安装HDF,将连接器(¼“-¼”,带鲁尔锁)插入静脉通路中。新型HDF系统由两个贝朗输液泵和一个定制HDF套件组成,其中包括一个膜表面为0.09m2,预充8 mL的血液滤过器HPH-Junior(HDS套件产品编号:No. M10414 Terumo, Tokyo, Japan ►图1)。HDF系统(包括血液滤过器)的总预充量为18 mL。HDF系统安装在血液侧,作为ECMO中的压力依赖性被动旁路(氧合器后;与新集成的¼“-¼”连接器连接的DP 3 ECMO泵前; ►图2)。HDF系统除气后,使用前倒置血液滤过器,使血液入口位于血液滤过器的最高点。这样放置,即使有小气泡也会被截留在血液滤过器的顶部入口处,不会返回ECMO系统。
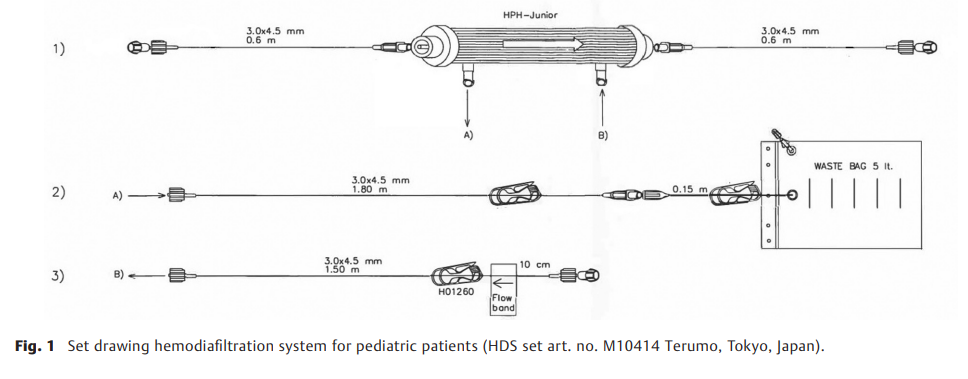
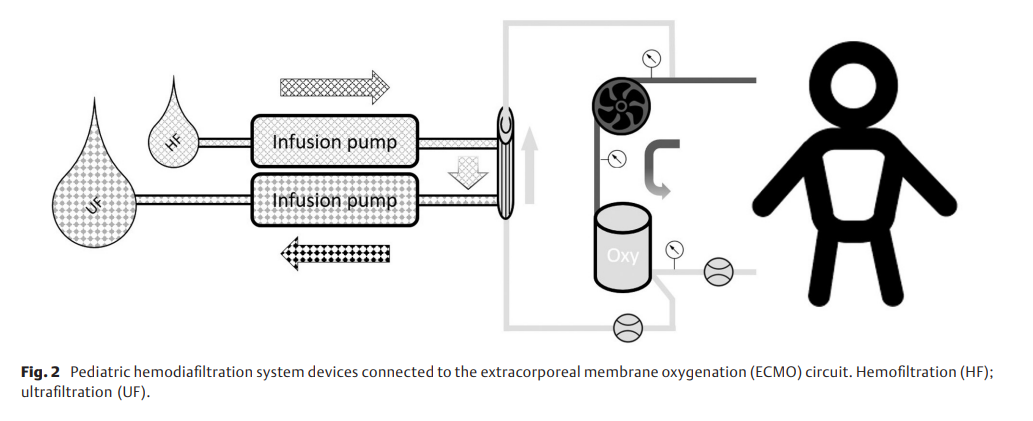
使用带有一次性灌注传感器R((Fumedica, Switzerland)的超声流量探头传感器监测HDF血流,灌注传感器R插入氧合器和连接至过滤器的管路之间。如有必要,可以通过300mL/min的 HPH-Junior 血液过滤器来调节最大允许流量。两条输注管路连接在血液滤过器的透析液侧。血液过滤溶液(例如,Duosol 4mmol/L K,B.Braun,Melsungen,Germany)作为透析液连接至血液滤过器的供应管路(标记为“入口”),第二条管路(标记为“引流管”)从血液滤过器连接至5 L废液袋,在废液袋中收集废水超滤液。两条输注管路的流量由两台Space P输注泵(B.Braun)调节和控制。为了获得更好的清除率和转移率,透析液以与血液流动方向相反的方向通过血液滤过器的膜。
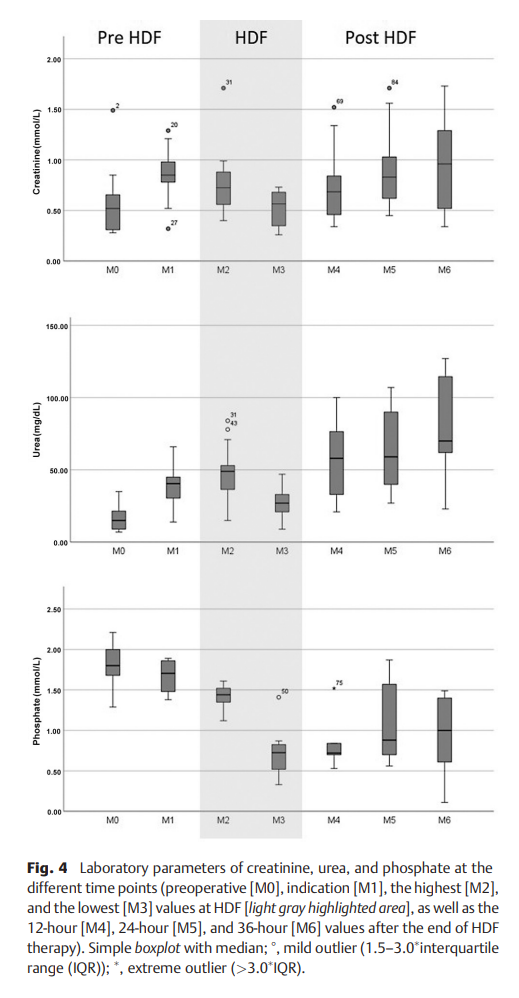
在6个时间点分析血清肌酐、尿素和磷酸盐情况。术前(M0)、手术与HDF治疗开始之间的最高值(M1)、最高值(M2)和最低值(M3)以及HDF治疗结束后12小时(M4)、24小时(M5)和36小时(M6)。结果数据分为ECMO等待组和出院组。
尽管安装了HDS,ECMO治疗的现有凝血管理保持不变(由于当地标准操作规程)。目标范围如下:活化部分凝血活酶时间(aPPT)为60 - 80秒;凝血酶原时间(Quick)>50%;抗凝血酶(AT)>90%;血小板> 90,000/µL;纤维蛋白原> 100 mg/dL;和10至12 g/dL的Hb。
用SPSS(版本28.0.0.0)进行统计分析。这些值以最小值和最大值的中间值给出。唯一的例外是血液滤过器的流量数据:以平均值±标准差的形式给出。
结果
在观察期内,13例年龄为8天的患者(最小:2;最大值:162),重3.8 kg(最小值:2.7;最大值:5.1)接受了15次这种类型的儿科HDF运行,并结合ECMO系统,可以进行回顾性分析(►表1)。
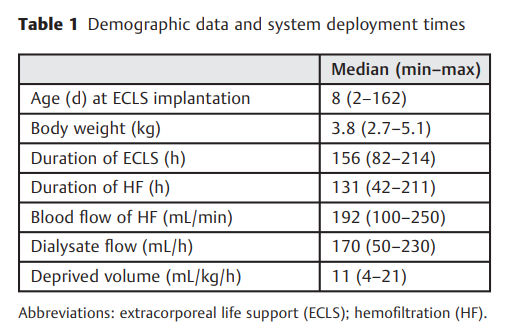
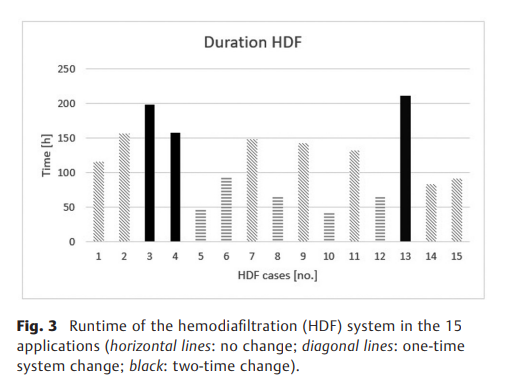
通过血液滤过器的平均被动和非节流血流量为192±50 mL/min,平均透析液流量为170±55 mL/h,平均容量剥夺为11±5mL/kg/h。HDF平均进行了131小时(最短:42小时;最长:211小时),其中7例患者更换血液滤过器一次,3例患者更换两次(►图3)。
在某些病例中,Space P输注泵中的输注管路在48小时后发生材料硬化,在这些所有病例中,这种情况可以通过将管路重新插入输注泵并偏移几厘米来纠正。所有病例均未记录与ECMO和HDF使用相关的技术问题。
肌酐、尿素和磷酸盐的实验室参数列于►图4。两种尿液物质均从M0增加至M1(肌酐:0.52 vs 0.88mmol/L;尿素:15 vs M1 41mg/dL)。磷酸盐从M0至M1降低(1.8 vs 1.7mmol/L)。
13例患者中,2例接受了2次ECMO治疗。1例患者在脱机后再次手术,之后需要第二次V-A ECMO治疗。另1例患者在术前和术后使用两个ECMO系统进行V-A ECMO支持,因此计数两次。15次ECMO运行中有12次可以脱机(80%; 10/13例患者)和8例患者出院回家(61%生存率)。
评论
通过在运行的ECMO系统上使用最小化的儿科HDF系统,可以成功治疗本系列患者的急性肾损伤和液体过载,并进行有效的体积去除和充分的毒素清除。
Gorga等人发现,在CRRT开始和结束时,ECMO儿科患者的过度水合是住院生存率的独立因素。在对60家提供ECMO治疗的儿科机构进行的调查中,发现在ECMO回路中使用某种形式的血液滤过器越来越普遍。45%的诊所使用传统透析机,而8%的诊所仅使用串联式血液过滤器,其余受访者报告使用两种仪器。
目前市场上可获得的最小透析系统是“Carpediem”(Medtronic),适用于体重在2.5至9.0 kg范围内的患者,最小预充体积为27 mL。使用本文介绍的系统,预充体积可减少33%。此外,装置没有血液-空气接触,这规避了可能产生气泡的风险。另一个优点是该HDF系统不需要额外的泵。血液滤过器利用动脉和静脉管路之间的压力梯度进行被动灌注。
为了不超过通过血液滤过器的最大血流量300 mL/min,在“AV分流器”中安装了一个内联流量传感器(Fumedica,Muri,Swiss)。通过控制流量,血液侧的凝块或损伤以及HDF系统的故障也将在早期阶段被检测到。使用集成在ECMO控制台中的流量测量仪,在氧合器后直接测量动脉插管的ECMO流量,并确保靶向治疗。
在一个技术行程中,DP3斜向泵流量与任何其他非封闭泵一样,取决于前负荷和后负荷。这意味着当AV分流器被打开用于HDF治疗时,在ECMO泵的相同速度下,患者的血流保持相对恒定。然而,通过氧合器后流量会增加,包括患者血流量加上HDF流量。因此,在使用过程中必须观察通过氧合器和泵头的最大允许流量。
AV分流器的使用有额外的优点。例如,在撤机期间,当患者血流量减少到,例如150 mL/min时,经由AV分流器的额外流量导致通过氧合器的总流量在350和400 mL/min之间,从而防止由于低流量而形成凝块。
在所有应用中,血液滤过器的透析性能一致。血容量消耗可在0 ~ 200 mL/h范围内调节。对于重症监护医生来说,这是一种专门对患者引流并减少水肿的可控方式。通过该系统可以对水-电解质平衡进行非常精细的控制。在非常小的患者中(≤3 kg; n=5),有时存在单独应用静脉内药物会导致明显正平衡的问题。这可以在早期阶段预防,不需要使用利尿剂,从而规避了伴随的肾毒性。
在ECMO回路中应用新的HDF系统后,血液侧未出现并发症。
由于ECMO支架上的输液泵尺寸小且能够安装,ECMO的移动性得以保留。在往返手术室、导管介入或影像学研究期间,无需暂停CRRT。
根据内部临床标准操作规程,HDF系统在72小时后进行“头端对头端”或ECMO系统更换。在观察期内,更换HDF系统时未发生并发症。在每一个病例中,18 mL的血量都可以完全输回婴儿体内,避免了不必要的失血。在极少数病例中,输液泵入口显示气泡报警。由于透析液袋为空,在两例病例中,血液滤过器的透析侧出现大量空气。通过更换溶液,系统可以继续快速运行。为安全避免该问题,输液泵上的预设血液滤过体积设置为4,800 mL,使用5,000 mL血液滤过溶液袋。输液泵也会发出警报,以避免透析液系统完全排空。
在建立HDF系统的同时,标准的“透析”实验室报告,其中也包含磷酸盐,用于咨询新生儿肾脏科。作者能够检测到几个病例中有治疗意义的低磷血症的发生。磷酸盐标准值设定在0.9 ~ 2.9 mmol/L之间,由于透析效率高,有时低于下限。这可以通过检测磷酸盐水平和通过向“混合袋”中添加补充剂来替代进行充分治疗。磷酸盐作为能量携带分子三磷酸腺苷(ATP)的重要组成部分是体内重要的能量供应者。严重的磷酸盐缺乏可导致意识模糊、癫痫发作、昏迷、呼吸动力受损、肠道活动减少和围手术期心肌衰弱。
这提供了证据,除了技术可行性之外,在ECMO运行的同时,可以对患有无尿的高水化婴儿进行足够的容量撤回。当使用HDF系统时,对角泵几乎不需要调整,以维持患者的稳定流量。由于血容量为18mL,儿科HDF系统不仅在技术上优于传统CRRT器械,而且在炎症反应或必要输血方面也优于传统CRRT器械。因此,连接最小化儿科HDF系统成为了传统CRRT手术的一种简单且温和的替代治疗选择。在病例系列的背景下,技术应用是安全的,并且系统与所述产品配合完美。
结论
在目前的分析中,通过跨学科的方法实现复杂儿科患者的现代治疗是可能的。除了有效的容量回撤以预防或减少水肿和急性术后肾衰竭外,作者所述ECMO上的儿科HDF在技术上是安全的,可成功应用于医学治疗。用于透析的附加血管通路,例如“Shaldon导管”可以在此免除。因此,通过ECMO连接最小化的儿科HDF是传统CRRT手术的一种简单且温和的替代方案。
本期中文解读
雷婉婷
/初稿
郑子龙
/初审
范成铭
/校审
范成铭,博士
The Thoracic and Cardiovascular Surgeon 编委
中南大学湘雅二医院
范成铭博士的研究方向是心血管外科、缺血性心脏病的干细胞治疗。他主持了国家自然科学基金青年项目、湖南省自然科学基金优秀青年项目等多项课题。已在国际期刊发表学术论文55篇。他还是美国心脏协会AHA成员、动脉硬化、血栓形成和血管生理学委员会成员、国际动脉粥样硬化学会会员。
德国胸心血管外科学会会刊。
The Thoracic and Cardiovascular Surgeon 发表来自国际公认的胸心血管外科医师、心脏病学家、麻醉学家、生理学家和病理学家的最高标准文章。本刊是这一领域工作者的重要资源。
原创论文、简讯、综述和重要会议公告将报告关键的临床进展,同时为读者提供心血管和胸外科的理论背景。病例报告在我们的开放获取姊妹期刊The Thoracic and Cardiovascular Surgeon Reports上发表。
