
#Thieme未来星计划荣誉推出消化病学专题,我们将与未来星计划的小伙伴们持续推荐解读与消化病学相关的最新研究,欢迎关注。同时,欢迎感兴趣的小伙伴加入我们。
本期推荐 & 解读 BY
单飞 | 南昌大学
↓ 消化病学专题丨13
EMR是在粘膜下注射和抬高后对息肉进行圈套切除术。ESD包含标记、粘膜下注射、切开和剥离等步骤。出血和穿孔是内镜手术后最常见的并发症,可以通过电凝和内镜夹闭来治疗。EMR的整体切除率为44.5%至63%,ESD的切除率为87.9%至96%。EMR和ESD后的复发率分别为7.4%-17%和0.9-2%。ESD足以治疗黏膜下层浸润小于1000μm、无淋巴血管浸润、组织学分化良好、低级别肿瘤萌芽和切缘阴性的情况下的浸润性癌。
内镜技术(如内镜黏膜切除术EMR、内镜黏膜下剥离术ESD、混合EMR/ESD)被引入切除复杂的结直肠息肉。虽然结肠的解剖结构复杂,包括褶皱、弯曲、壁薄和管腔窄(图1),但结肠EMR和ESD比传统内镜切除术整体切除率更高。
Clinics in Colon and Rectal Surgery
Endoscopic Mucosal Resection and Endoscopic Submucosal Dissection
Sumeyye Yilmaz, Emre Gorgun
中文内容仅供参考,以英文原文为准,欢迎识别二维码阅读。
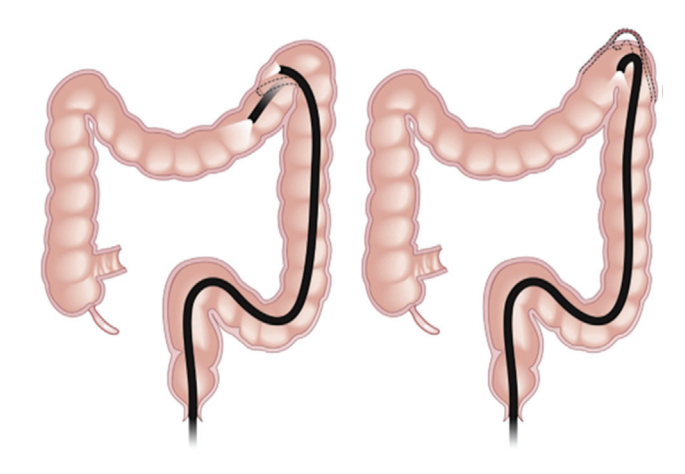
图1. 弯曲中的结肠镜操作。
EMR和ESD的适应症
结直肠癌指南建议通过冷圈套息肉切除术切除<10mm的结直肠病变,并对10至19mm的非息肉样和锯齿状病变进行EMR。治疗无蒂大尺寸病变(> 20 mm),可同时使用EMR和ESD。对于> 20 mm的病变,建议使用ESD。除大面积息肉外,任何难以使用常规技术或EMR整体切除的病变(如位置深,既往手术切除导致纤维化)都可通过ESD治疗。
术前治疗
进行术前评估是术前关键。抗凝剂术前应停用5至7天。应由内镜医生评估既往结肠镜检查报告。机械肠道准备是正确观察病变的另一个关键步骤。虽然泻药(如磷酸钠溶液)可能会导致电解质发生紊乱,但聚乙二醇溶液广泛可用,且大多患者耐受性良好。
设置和设备
内镜检查套件
包含具有良好弯曲范围和射水功能的结肠镜,保持清晰的内镜视图。建议使用CO2进行扩张结肠腔,可减少腹痛和腹胀(图2)。在EMR和ESD期间,还需要高频发生器和自动控制系统的电切、电凝装置。

图2. 一个具有良好弯曲范围的结肠镜,二氧化碳充气(在右边),和高频发生器。
操作设备
各种圈套器和刀具可用于内镜切除术。圈套主要用于EMR和混合EMR/ESD。息肉切除术圈套器由一个连接到塑料护套内长连接器的线环组成,该连接器通过电线连接到电机。它们具有不同的大小和形状(图3),可以根据病变大小、形态、位置和术者习惯进行选择。
电刀用于切开和分离。有三组刀,即针型、绝缘尖端(IT)和镊子类型(图 4)。
手术步骤
黏膜下注射
为了降低内镜切除术期间穿孔和透壁热损伤的风险,充分抬高粘膜下层至关重要。通过将溶液注入粘膜下平面,形成粘膜下垫,并将病变与固有肌层分离(图 5)。对于粘膜下注射,针头应切向插入。一旦将溶液注射到粘膜下平面中,就会观察到抬高。在正确的平面上进行注射,病灶未抬高,称为“非抬高标志”(图 6),这表明存在恶性肿瘤。
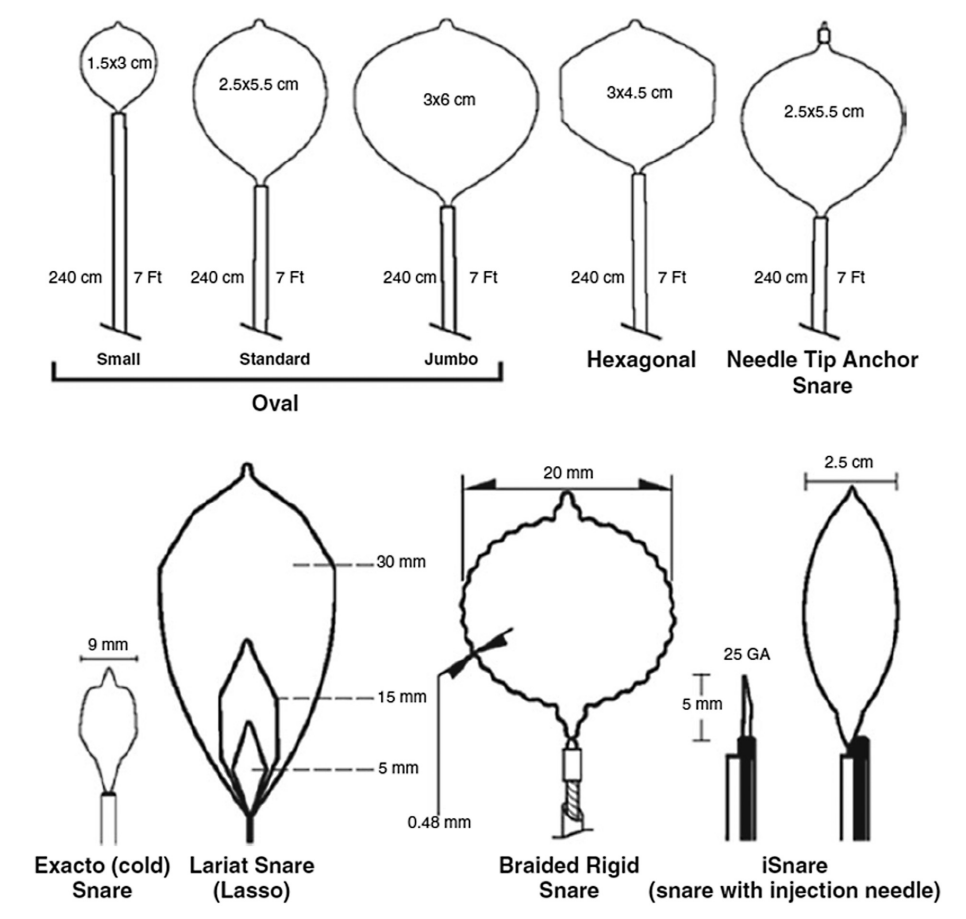
图3. 用于内镜切除技术的不同圈套器类型。
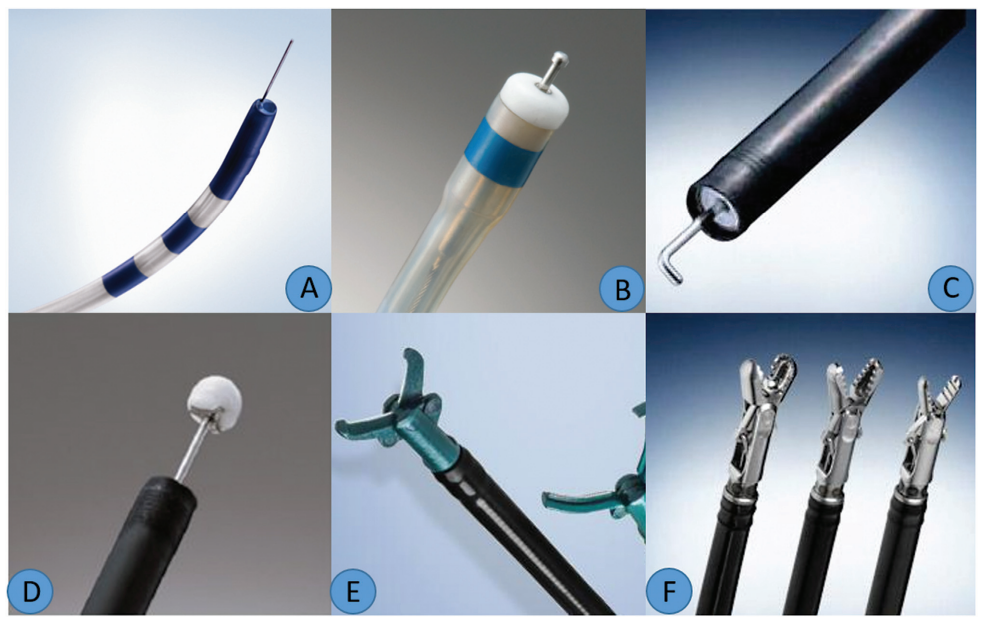
图4. 内镜下切除技术使用的不同的刀具。
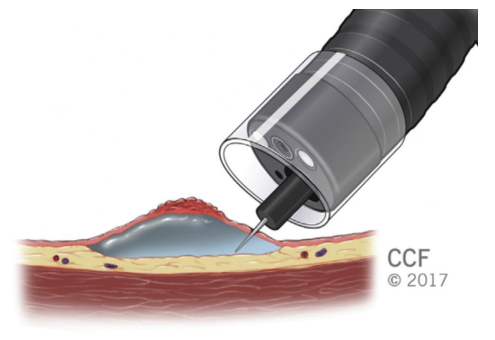
图5. 粘膜下注射
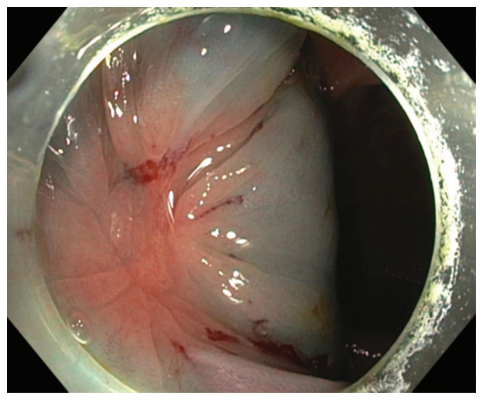
图6. 非抬高标志。注射溶液不会抬高病变,但会抬高其周围的正常粘膜下层。在内镜下,可见肿瘤外的隆起。
注射溶液包含两种常见元素:胶体(高渗)溶液和惰性染料(例如靛蓝胭脂红或亚甲蓝),以促进组织平面的可视化。此外,可以使用稀释的肾上腺素(1 mL 0.1% 肾上腺素)和与亚甲蓝或其他染料混合的羟乙基淀粉溶液。
内镜下黏膜切除术
EMR包括在粘膜下注射阶段后使用圈套进行切除(图 7)。对于EMR,病灶应位于5至6点钟位置。EMR期间的目标是实现2至3 mm阴性粘膜边缘的整块切除。推荐使用冷圈套切除术。研究表明使用冷圈套切除术可增加标本损伤率和阳性切缘。
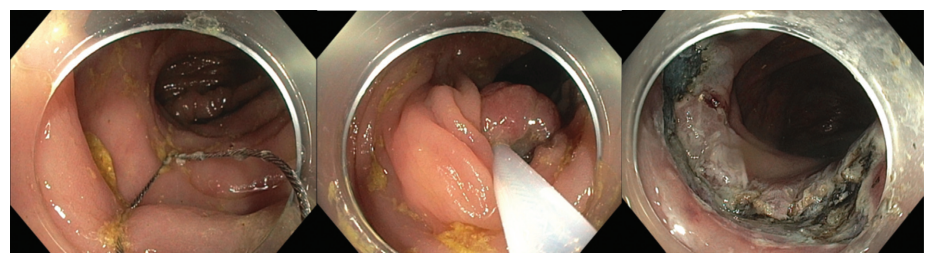
图7. 利用圈套器进行内窥镜粘膜切除术 (EMR)。
内镜下粘膜下剥离术
ESD涉及几个步骤(图8和图9)。首先使用电凝术标记病变。粘膜下注射后,从病灶的近端开始进行环形切口(图 10)。切开圆周一半,就在这一半进行粘膜下清扫。对病变的远端半部重复切开和分离。为了便于粘膜下剥离,需要在内窥镜尖端安装一个透明罩子。
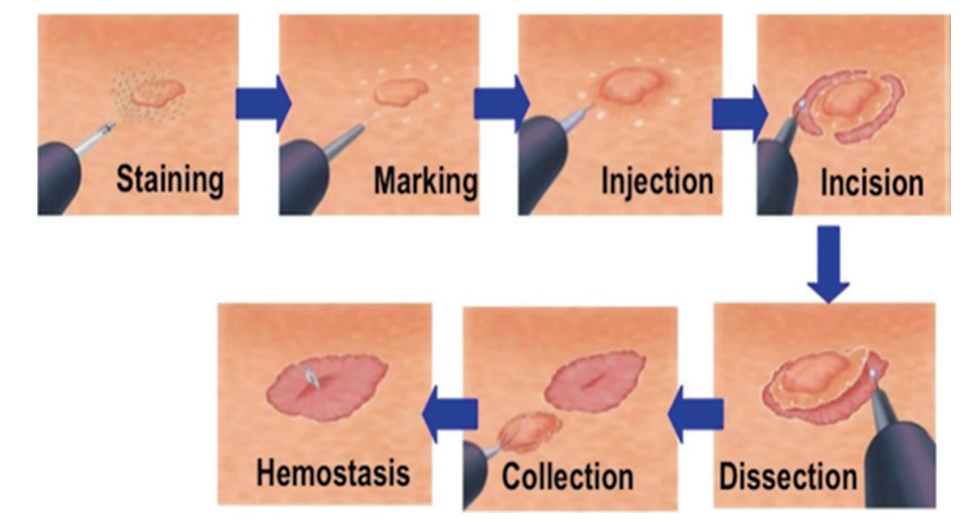
图8. 内镜粘膜下剥离术(ESD)的步骤。
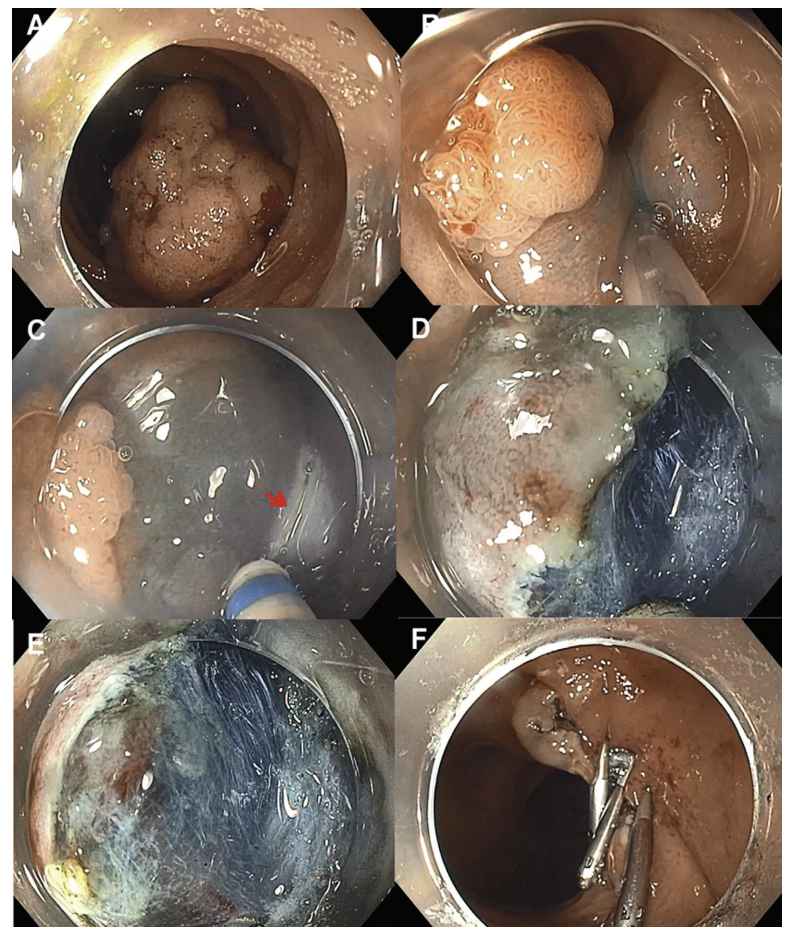
图9 .(A) 内窥镜黏膜下剥离术(ESD)的手术步骤。(B)病灶可视化,黏膜下注射,(C)开始切开,(D和E)在粘膜下平面继续分离,(F)用夹子闭合缺损。
混合 EMR/ESD
病变无论大小,ESD都可以切除。另一方面,EMR不适用于大面积病变、因位置或既往切除而难以切除的病变。引入混合EMR/ESD技术是为了克服这两种技术的局限性,并提供比EMR更可靠但比ESD更快的切除。
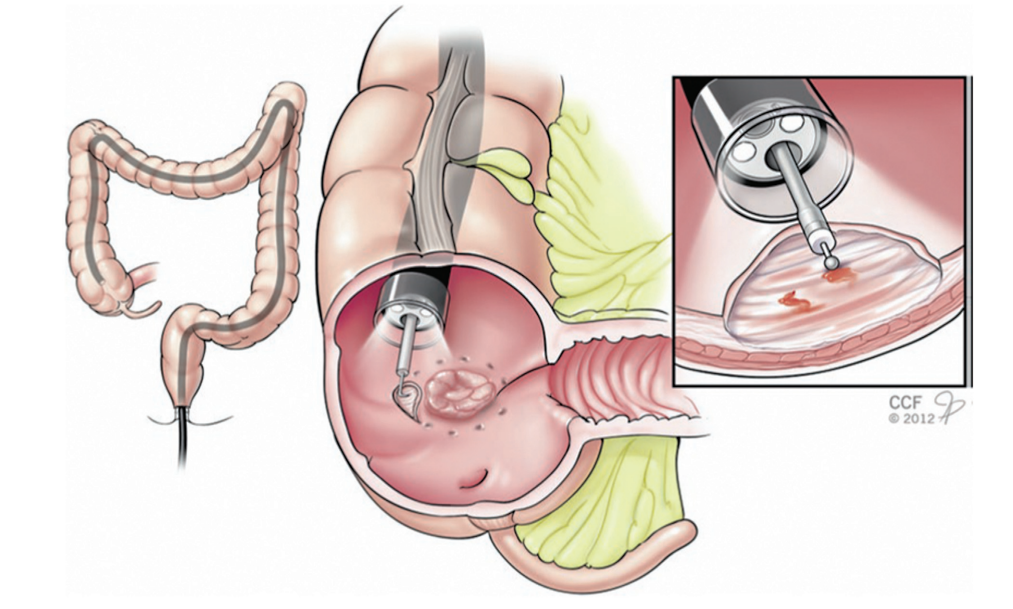
图10. 内窥镜粘膜下剥离和粘膜下平面分离的方向
术后并发症
出血
出血是结直肠EMR和ESD的主要并发症之一,可以在术中、立即(24 小时内)或延迟观察到。研究报告称,EMR的延迟出血率为1.4% 至3.5%,ESD的延迟出血率为1.5%至2.8%。
出血可以通过电凝或用止血夹治疗。大血管的出血可以用止血夹治疗(图11)。使用止血夹时,应尽量减少电凝术,减少热损伤和迟发性穿孔。
穿孔
结肠壁较薄,且结肠内的内镜操作空间有限,结肠手术穿孔率高于胃手术。穿孔是结直肠EMR和ESD最严重的并发症。延迟穿孔通常是由热损伤引起的。EMR和ESD后穿孔的发生率分别为0-1.4%和2-10.7%。最常见的穿孔部位通常是乙状结肠,其次是盲肠结肠、升结肠、横结肠和降结肠。大多数穿孔都是通过内镜闭合技术(例如夹子、环、缝合)治疗(图12和图13)。
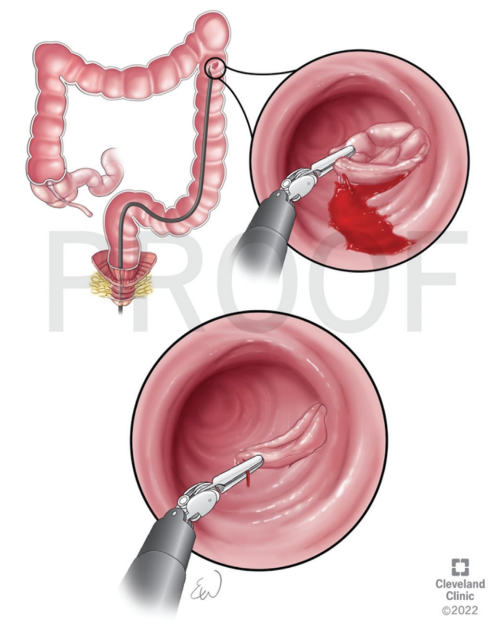
图11. 使用止血钳治疗内窥镜粘膜下剥离术(ESD)期间出血。
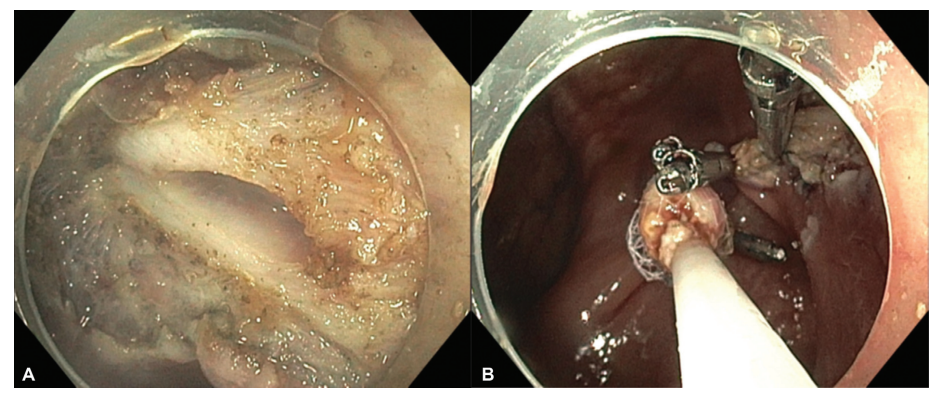
图12.(A)内窥镜黏膜下剥离术(ESD)后结肠壁缺损,(B)放置内窥镜夹闭合。
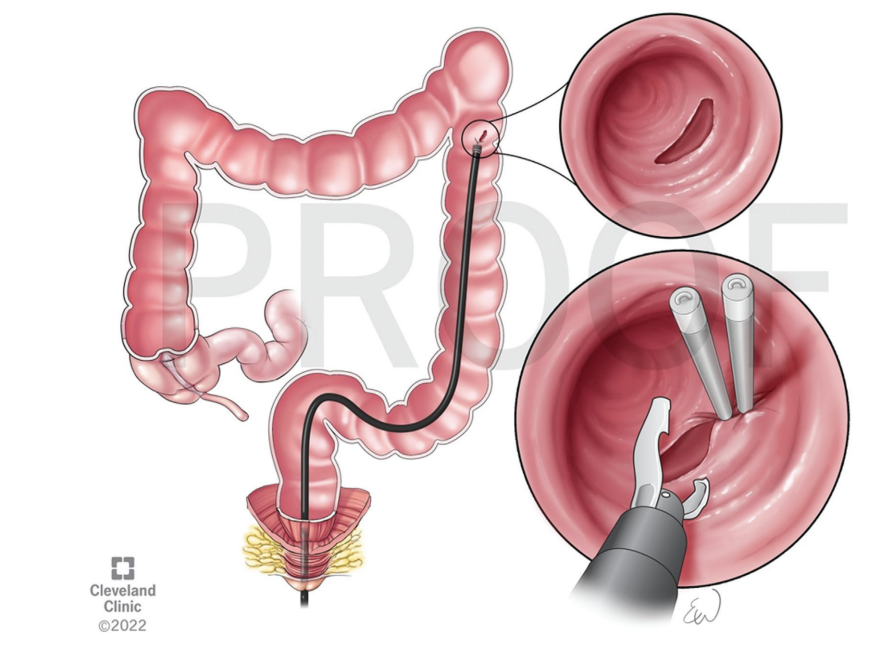
图13. 内窥镜夹在穿孔中的应用
结果
整体和 R0 切除术
整体切除是指将息肉整体切除(图14),而R0/完全切除定义为组织学上无病的边缘息肉切除。研究报告了更高的整体切除率和 R0 ESD。EMR后常见局部复发。EMR的整体切除率为44.5%至63%,ESD从87.9%到96%。同样,EMR 和ESD的R0切除范围为42.3%至65.5%和72%至85%,使用ESD,即使对于大型肿瘤,也可以实现较高的整体切除率(94.9%)和R0切除率(79.7%)。
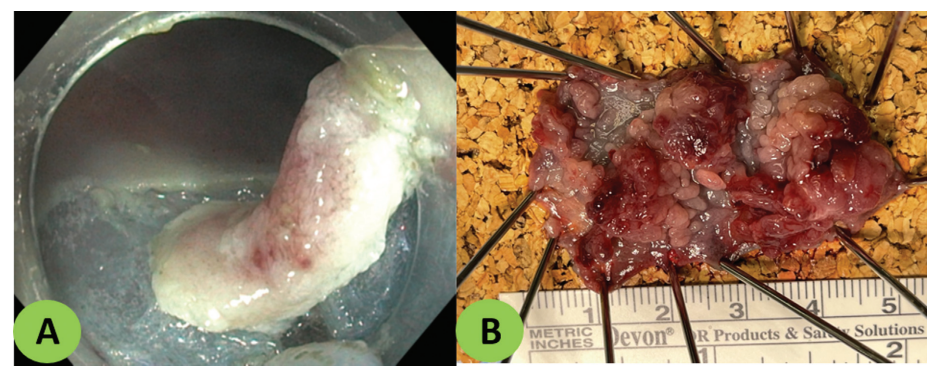
图 14. (A)标本整体切除术,内窥镜视图。(B)整体切除后的标本。
结论
对筛查和息肉切除术的日益重视导致结直肠癌发病率和死亡率显着降低。从历史上看,手术是传统技术无法切除的息肉的首选治疗方法。先进的内镜技术被广泛用于治疗这些病变。与传统的息肉切除术相比,它们提供更高的整体切除率,同时帮助患者减少与结肠切除术相关的发病率和死亡率。EMR包括通过将液体注入粘膜下来抬起病变并使用圈套进行切除。ESD有几个步骤,包括标记、粘膜下注射、切开和剥离。与EMR相比,ESD与较高的整体切除率和R0切除率以及较低的复发率相关。
讨论
多达15%的结直肠息肉适合常规息肉切除术。与传统技术相比,它们整体切除率更高。≤20mm的息肉是可以通过息肉切除术或内镜粘膜切除术(EMR)整体切除。对于>20 mm的息肉,建议进行内镜粘膜下剥离术(ESD)。黏膜内癌和黏膜下浸润有限的癌也可以用ESD切除。在内镜下切除术中,识别恶性肿瘤非常重要。黏膜内癌和对粘膜下层的有限浸润的恶性肿瘤,一旦确保边缘阴性,即可立即通过内镜切除。如果存在任何不良预后因素,则需要随后进行肿瘤外科切除。为了验证病变的完全切除,建议在3至6个月后进行后续结肠镜检查。
Clinics in Colon and Rectal Surgery 为综述类期刊,出版有关小肠、结肠、直肠和肛门疾病的专题。
本刊专门面向涉及肠道疾病的临床医生、研究人员和教育工作者,广泛涵盖了基础信息、有争议的临床问题以及成熟和创新性诊断技术。
期刊主题全面覆盖整个专业,可作为 3 - 4 年的教育课程和认证考试的学习材料。所包含的研究和临床资料还能够使医生随时了解该专业的最新进展。
