
TAVR术中心肺复苏患者的结局和特征
Gerfer et al.
Thorac Cardiovasc Surg 2023; 71(02): 101-106
DOI: 10.1055/s-0042-1750304
关键词:TAVR、心肺复苏、CPR、低射血分数

背景:经导管主动脉瓣置换术(TAVR)已成为高危患者外科主动脉瓣置换术(AVR)的一种替代方案。TAVR围手术期并发症随着植入者专业知识的增加而减少。然而,TAVR可伴有危及生命的不良事件,如术中心肺复苏(CPR)。本研究回顾性分析了在TAVR期间接受围手术期CPR的大型心脏中心患者队列的预测因素和结局。
方法:对729例TAVR患者(包括59例术中CPR患者)的手术前后情况进行分析。
结果:接受CPR的患者左室射血分数(LVEF)明显降低,平均跨瓣压差和峰值压力梯度明显降低。CPR组术前直接测量的收缩压明显较低。CPR患者更需要术中除颤、心肺循环支持和转换为心内直视手术。此外,III 度房室传导阻滞、瓣膜错位和心包填塞的发生率较高。术中CPR后的住院死亡率显著升高,更高的致残脑卒中发生率、植入新的心脏起搏器、输血次数增多和在重症监护病房住院时间延长。
结论:术前LVEF受损和瓣膜放置前血流动力学不稳定是心肺复苏的独立危险因素,与预后不良相关。心律紊乱、瓣膜错位和心包填塞是心肺复苏术组高死亡率(17%)的主要原因。尽管如此,机械循环支持和转换为心内直视手术降低了心肺复苏患者的死亡率。
背景
对于严重主动脉瓣狭窄的高危患者,经导管主动脉瓣置换术(TAVR)是一种公认的替代外科主动脉瓣置换术(AVR)的方法。随着手术量和植入者的专业知识的增加,术中并发症逐渐减少,TAVR以低死亡率和低卒中率显示出良好的术后结果。PARTNER 3研究和Evolut Low Risk Trial试验显示,接受TAVR且手术风险较低的患者在12个月和24个月后死亡率和卒中率较低。在这些研究中,TAVR在重度主动脉瓣狭窄低风险患者中的优越性已得到证实。然而,TAVR可能伴有危及生命的不良事件,如术中心肺复苏(CPR),导致手术结局较差。为了避免这些情况,植入者必须意识到导致血流动力学不稳定的潜在危险因素,并为紧急情况做好准备。术中CPR已被描述为急性失代偿高危患者院内死亡率的预测因子。与急诊TAVR相比,在失代偿性心力衰竭患者中,作者旨在研究TAVR期间接受CPR的大型心脏中心的患者队列的预测因素和结局。
方法
研究人群
对2014年1月至2016年12月期间在本中心连续接受TAVR治疗的729例患者进行了分析。在这些患者中,有59名患者在发生了危及生命的CPR不良事件。为了了解可能导致术中 CPR的情况,本研究回顾性分析了TAVR期间进行CPR患者的预测因素和结果。
一般情况下,经股动脉TAVR手术在局部麻醉下进行。对经心尖或经主动脉TAVR和不稳定的患者行全身麻醉。手术由心脏团队在杂交手术室进行,包括一名心内科医生和一名心外科医生,并有一名麻醉医生陪同。在血液动力学不稳定或CPR时,将局部麻醉改为全身麻醉。根据CPR的假定原因进行CPR并排除主要问题(如心律紊乱时植入除颤或起搏器,急性出血时进行容量置换,心包积液或填塞予以穿刺引流,在瓣膜错位或冠状动脉阻塞的情况下,转换为直视手术)。如果出现难治性血液动力学不稳定和正在进行的CPR的情况,则启动体外机械循环支持,必要时转为心脏直视手术。TAVR患者术后病程与接受CPR患者和未接受CPR患者相似,所有患者都被转移到重症监护病房至少一个晚上,以观察术后心肺稳定性。
关注的变量
对TAVR期间接受CPR和未接受CPR的患者的术前特征进行比较,如年龄和性别、冠状动脉病变数量、外周动脉疾病、慢性阻塞性肺疾病、房颤和既往心脏手术史。此外,将超声心动图数据LVEF和平均压力梯度(MPG)和峰值压力梯度(PPG)视为组间的相关参数。术前收缩压和舒张压也包括在内。
评估术中关于股动脉入路、手术时间、瓣膜内植入术、快速起搏、瓣膜成形术和球囊扩张术的特点。对术中除颤和新发房室传导阻滞 III 级(AV-Block III)的病例进行队列间比较。此外,记录了转行心内直视手术和心肺循环支持,以及包括心包填塞、冠状动脉阻塞和室间隔穿孔的术中不良事件。
针对接受CPR与未接受CPR TAVR患者的术后结局,分析了包括心肺死亡、大出血相关死亡、脑血管死亡等在内的住院死亡率。此外,还比较了术后脓毒症、脑卒中、短暂性脑缺血发作(TIA)和AV-Block III导致的新起搏器植入等不良事件。评估住院和ICU停留时间以及红细胞输血情况。
统计分析
使用SPSS Statistics 25 (IBM Corporation, New York, Armonk,United States)进行统计分析。如数据表所示,对于连续变量,所有数据均以均值和标准差(SD)表示,对于未配对数据采用Mann-Whitney U检验进行分析。分类变量用百分比(数)表示。用卡方检验或费歇尔精确检验来分析分类变量之间的差异。p值小于0.05 视为有统计学意义。多元分析采用 Hosmer-Lemeshow检验进行二元逻辑回归分析。数据以95%置信区间的比值比(OR)表示
结果
患者术前特征
对于本分析中包括的所有患者,参数显示为 n(%)。接受TACR时需要CPR组和非CPR组的患者年龄(82±7 vs 81±6岁)以及女性患者的数量(n=25 vs 335;42 vs 50%)、冠状动脉疾病(n=37vs 383;63 vs 57%)、外周动脉疾病(n=8 vs 116;14 vs17%)、房颤(n=25 vs 314;42比47%),既往心脏手术史(n=18 vs 138;31 vs 21%)组间差异无统计学意义(p>0.05)。未接受CPR组慢性阻塞性肺疾病患者人数较高(n= 9 vs 196;15 vs 29%,p=0.022)。需要进行术中CPR的患者术前 LVEF 较低(46±14 vs 54±13 mm Hg, p<0.001),而且基线跨瓣MPG和PPG也较低 (MPG: 38±16 vs 45±17mm Hg;PPG:65±25 vs 72±2 mm Hg, p<0.05)。在CPR队列中,术前直接测量的收缩压明显较低(115±13 vs 120±15 mm Hg, p<0.05),但舒张压无差异(54±8 vs 57±9 mm Hg,p=0.073)。术前特征见表1。
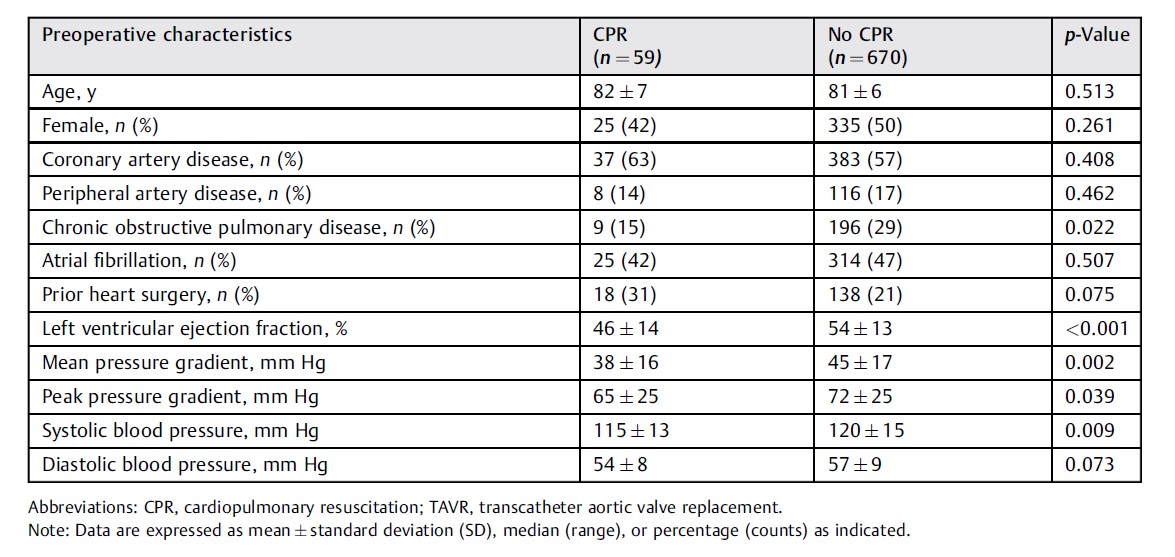
表1 | TAVR期间接受CPR和未接受CPR患者的术前特征
术中特征
在术中接受CPR和未接受CPR的患者之间,经股动脉入路的数量很好地达到平衡(n = 54 vs 582;92 vs 87%;P=0.304)。其他非经股动脉入路为经心尖动脉入路(CPR n=4 vs 无 CPR n=73;6.8 vs 19.9%;p=0.324)和经主动脉入路(CPR n=1 vs 无 CPR n=15;1.7 vs 2.2%;P=1.000)。接受CPR组手术时间明显延长(110±59 vs 87±31分钟,p<0.05),“瓣中瓣”植入的次数(n=3 vs 25;5.1 vs 37%),快速起搏(n=52 vs 629;88 vs 94%),瓣膜成形术(n=28 比 360;47 vs 54%),球囊扩张(n=43 vs 508;73 vs 76%)组间差异无统计学意义(p >0.05)。CPR组中的术中除颤明显更常见(n = 22 vs 29;37 vs 4.3%;p < 0.001),以及新发AV-Block III (n=14 vs70;24 vs 10%;P=0.002)。心肺循环支持(n=16 vs 9;27 vs 13%;P < 0.001)和需转为心内直视手术(n=9 vs 5;15 vs 7.5%;P < 0.001) 心包填塞 (n=4 vs 12;6.8 vs 1.8%;P=0.034)和瓣膜错位(n=6 vs 26;10 vs 3.9%;p = 0.037)在接受CPR组中更为常见。冠状动脉阻塞的不良事件(n=1 vs1;1.7 vs 0.1%)和室间隔穿孔(n=2 vs 3;3.4 vs 0.4%)差异无统计学意义(p>0.05)。术中特征见表2。
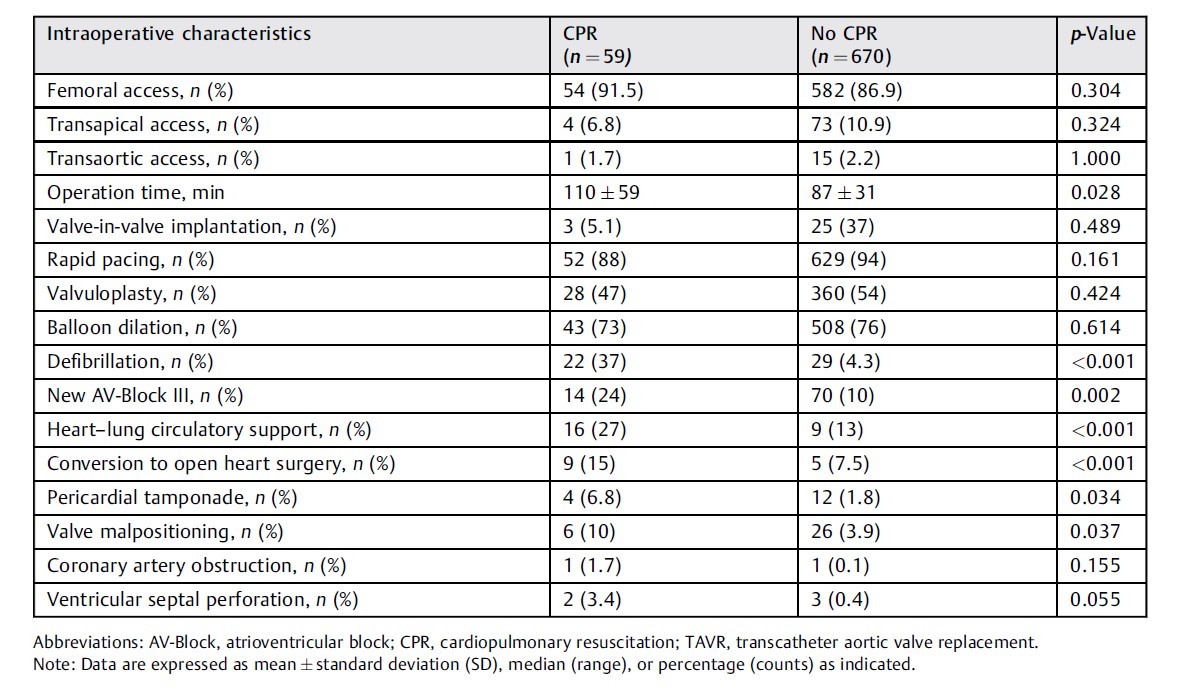
表2 | TAVR期间接受CPR和未接受CPR患者的术中特征
术后结果
接受CPR组的住院死亡率显著升高(n=10 vs 16;17 vs 2.4%;P<0.001),主要由心肺原因导致(n=5 vs 13;8.5 vs 2.0%;P = 0.011) 和重大出血并发症 (n = 4 vs 1;6.8 vs 0.1%;P <0.001)。脑血管原因导致短期死亡仅在未接受CPR组发现(n=0 vs 2;0.0 vs 0.3%;P=1.000)。术中接受CPR患者表现出更高的脑卒中致残率(n=5 vs 10;8.5 vs 1.5%;P =0.005) 和更多新的起搏器植入(n = 13 vs 71;22% vs 11%;p=0.008)和更长的 ICU住院时间(6±8 vs 3±4 天;P =0.011),需要更多红细胞输注(3.7±6.3 vs 0.7±1.6单位;P<0.001)。术后脓毒症的发生率 (n=4 vs 16;6.8 vs 1.4%;p=0.070),TIA (1.7 vs 0.7%;P=0.398)和总住院时间(11±10 vs 9±5天;P=0.247)在两组之间差异无统计学意义。术后结果见表3。
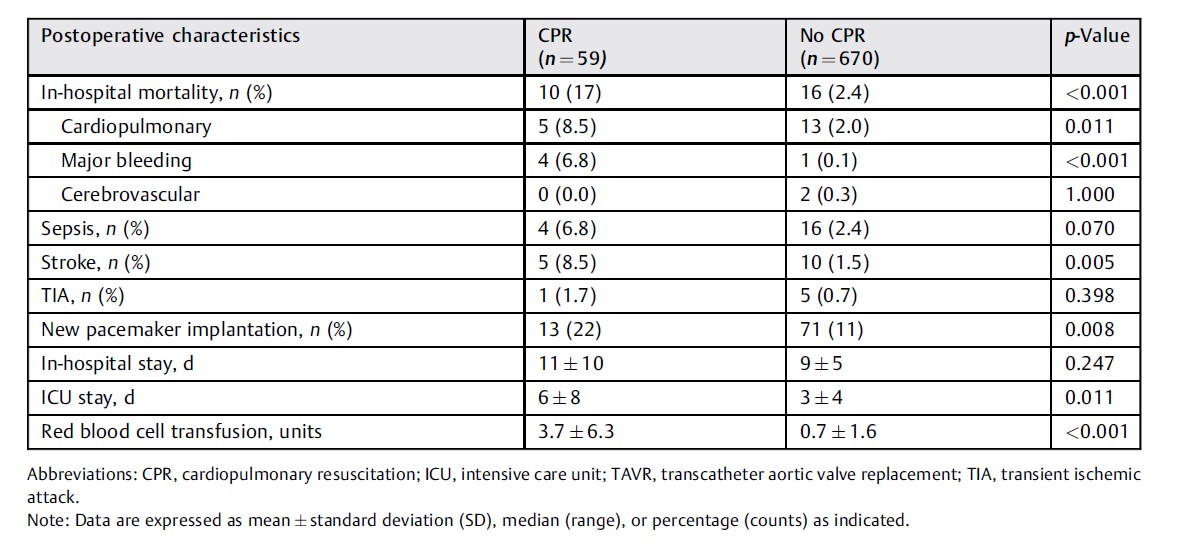
表3 | TAVR期间接受CPR和未接受CPR患者的术后特征
多元分析
采用多因素分析评估TAVR期间CPR的术前和术中预测因素,如表4所示。
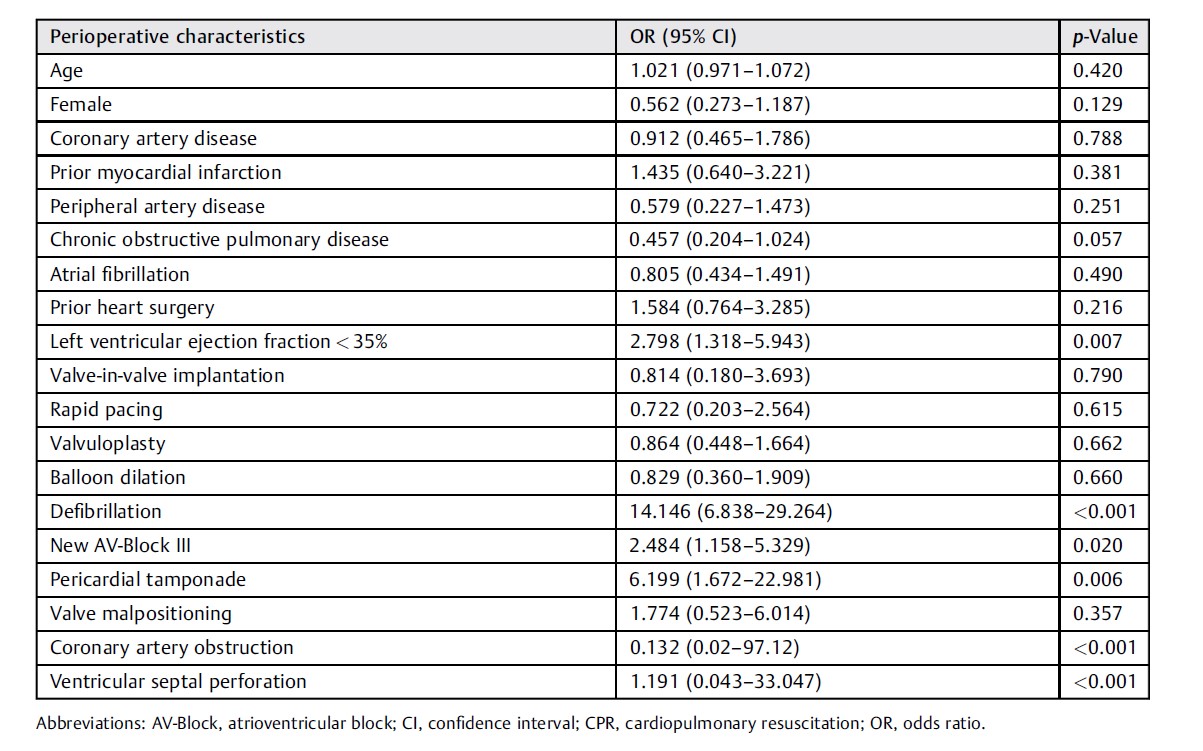
表4 | 围手术期CPR预测因子
评论
本文作者的主要研究结果如下。首先,LVEF降低与TAVR术中CPR发生率升高相关。因此,与未接受CPR患者相比,接受CPR患者收缩压显著降低和较低的PPG和MPG。第二,需要术中CPR的患者发生心包填塞和瓣膜错位的不良事件的概率更高,这导致心内直视手术和心肺循环支持的转换率更高,和更高的红细胞输注需求。第三,心律紊乱,包括AV-Block III 、植入新的心脏起搏器和需要除颤在CPR组中更常见。第四,评估术后患者致残性卒中和ICU住院时间延长的术后发生率,术后死亡率明显更高。
伴低LVEF和低流量、低梯度主动脉狭窄的心功能不全与接受TAVR患者短期和1年死亡率增加相关。因此,心输出量减少和术中血压不良的患者与EF正常和血流动力学稳定的患者相比死亡率更高。考虑到这一点,植入者必须意识到术中血流动力学不稳定导致严重不良事件(如CPR)的风险更高。因此,LVEF降低,主动脉压降低梯度和术前血压可作为术中血流动力学不稳定的预测指标。如前所述,心包积液或心包填塞是常见的血流动力学不稳定因素,占术中不良心脏事件的三分之一。其他更常见事件可由于瓣膜错位伴器械栓塞、主动脉根部破裂或冠状动脉阻塞引起。正如作者在研究中所观察到的,瓣膜定位错误和心包填塞是术中CPR最常见的原因。
队列中,与未接受CPR的患者相比,需要转为心内直视手术或需要循环支持的患者明显更多。在TAVR期间接受手术救助的患者表现出高达50%的10倍的短期死亡率,这一点不足为奇。至少四分之一的高危患者出现危及生命的节律紊乱,导致术中除颤和急性房室传导阻滞III,这与更大的TAVR人群中发生的传导紊乱和连续起搏器植入相当。尽管如此,CPR后观察到的术后脑卒中发生率增加了 5倍,而在低风险患者群体中通常为1 - 2%。CPR组中主要由心肺或大出血引起的短期死亡率增加了7倍。因此,该组需要输注更多的红细胞。
在729例连续队列分析患者中,3.4% (n=25)的患者需要机械循环支持。值得注意的是,在TAVR期间,16名接受机械循环支持的患者进行了术中 CPR,该高危患者队列的总生存率为75% (n=12)。在整个队列(n = 729)中,有1.9% (n = 14)的患者需要转换为心内直视手术,其中 9例患者进行了术中CPR。这类患者的生存率超过 66% (n=6)。考虑到现实的数据很难与低风险试验的结果相匹配,因为这些患者都是被精确挑选出的,所以并发症相对较低,但比假设发生更多——即使在具有丰富经验的大型心脏中心也是如此。
点评
本文通过对TAVR术中接受CPR和未接受CPR的患者术前特征、术中特征和术后结果进行回顾性分析得到了TAVR期间CPR的术前和术中预测因素,并采用多因素分析对其进行了评估。最终得出术前 LVEF和血流动力学障碍是TAVR期间接受CPR的患者预后较差的主要原因。此外,心律失常,瓣膜错位和心包填塞是高死亡率的主要原因。研究局限为回顾性和单中心设计队列较小,研究缺乏长期生存数据和患者随访数据。
中文内容仅供参考,一切以英文原文为准。
本期论文中文解读
雷婉婷
/初稿
郑子龙
/初审
范成铭
/校审
范成铭,博士
The Thoracic and Cardiovascular Surgeon 编委
中南大学湘雅二医院
范成铭博士的研究方向是心血管外科、缺血性心脏病的干细胞治疗。他主持了国家自然科学基金青年项目、湖南省自然科学基金优秀青年项目等多项课题。已在国际期刊发表学术论文55篇。他还是美国心脏协会AHA成员、动脉硬化、血栓形成和血管生理学委员会成员、国际动脉粥样硬化学会会员。
